センター長挨拶
当院の臨床試験管理センターのホームページをご訪問頂き有難うございます。
新規医薬品・医療機器などの開発においては、市販される前の医薬品や医療機器を患者さんに使用していただき、その有効性と安全性を確認するという臨床試験が必要になります。
臨床試験管理センターは、臨床試験を安全、倫理的かつ科学的に遂行するために、患者さん―研究責任者―企業などの間を調整する要としての役割を担います。
エビデンスに基づいた標準医療(evidence based medicine: EBM)を確立し、世界に発信すべく、適正な臨床研究を円滑に実施するための支援に努めています。
皆様のご支援、ご協力をよろしくお願い申し上げます。
臨床試験管理センター長
新岡 丈典
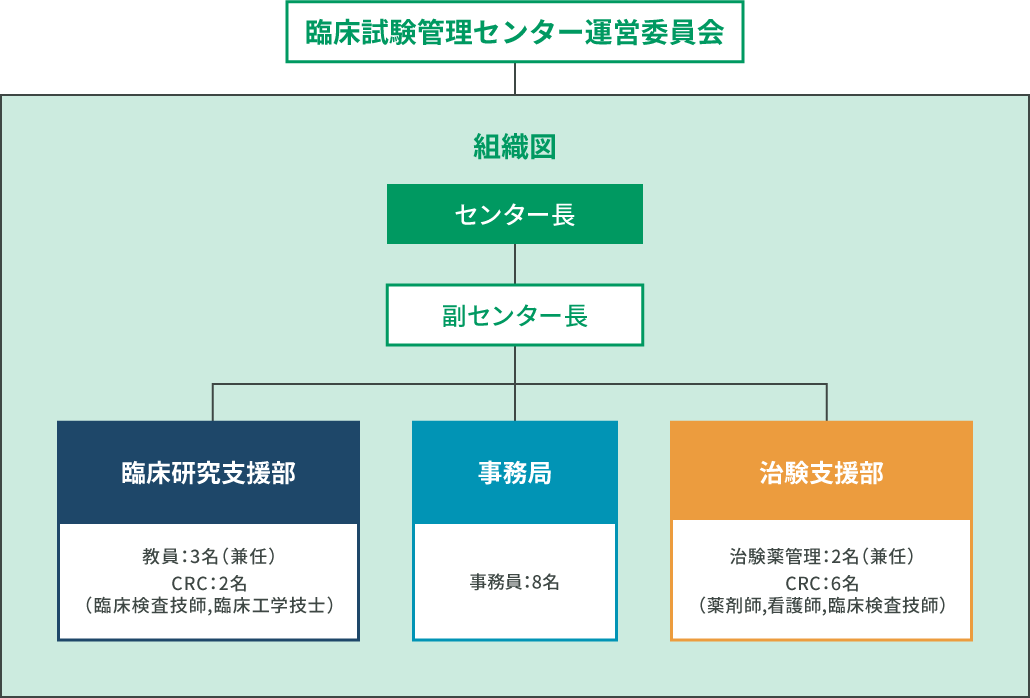
臨床試験管理センター運営委員会
組織図
各部門の業務
センター事務局
事務部門
- 治験(医師主導を含む)依頼手続きの補助
- 治験費用への対応
- 医薬品等臨床研究審査委員会(IRB)に係る要件調査および関連文書作成
- 必須文書保管・管理
- 治験依頼者のモニタリング・監査への協力
- 被験者募集の取り組み
- 臨床研究審査委員会事務局業務
- 再生医療等委員会事務局業務 など
治験支援部
治験薬管理部門
- 治験薬の調剤および管理(搬入,回収等)
- 処方オーダリングにおけるマスター登録
- モニタリング・監査への対応 など
CRC部門
- 被験者に関する業務(医学的判断を伴わない)
- 患者データベースを用いた候補患者数の把握,適格性確認,被験者登録
- 治験の説明と同意の取得補助(インフォームド・コンセントの補助)
- 受診スケジュールの管理
- 被験者ケア,相談窓口としての対応
- 有害事象のチェックと治験責任(分担)医師への報告
- 症例報告書作成の補助 など
- 治験チームの調整業務
- 各種ミーティングの開催準備
- 治験関連部門への説明
- 治験薬管理者,臨床検査担当者および治験依頼者との連絡・協議
- モニタリング・監査への対応 など
臨床研究支援部
CRC部門
- 被験者に関する業務(医学的判断を伴わない)
- 試験の説明と同意の取得補助(インフォームド・コンセントの補助)
- 受診スケジュールの管理
- 被験者ケア,相談窓口としての対応
- 疾病等のチェックと試験責任(分担)医師への報告
- 症例報告書作成の補助 など
- 試験チームの調整業務
- 必要に応じて各種ミーティングの開催準備
- 試験関連部門への説明
- 試験薬管理者,臨床検査担当者および研究代表者等との連絡・協議
- モニタリング・監査への対応 など
※なお、臨床研究におけるCRCの支援内容および費用については、相談のうえで決定します
沿革
| 1998年10月 | 治験事務局設置 |
|---|---|
| 1999年5月 | 治験事務局発足 |
| 2000年4月 | 治験管理センターに改組 |
| 2013年7月 | 臨床試験管理センターに改組 |
| 2017年5月 | 国立大学法人認定再生医療等委員会 設置 |
| 2018年8月 | 国立大学法人弘前大学臨床研究審査委員会 設置 |